
Le vieillissement normal – première partie : systèmes cardiovasculaire, respiratoire, gastro-intestinal
Conférencière : Karen Fruetel, M. Éd., M.D., FRCPC, Division de médecine gériatrique, Université de Calgary, Calgary, AB.
La Dre Karen Fruetel, dans son examen des changements physiologiques accompagnant le vieillissement, a souligné le fait que les caractéristiques du « vieillissement normal » sont dérivées d’études cliniques. Il s’agit soit d’études transversales, ce qui signifie que les indicateurs de santé sont dérivés de comparaisons entre des cohortes d’âges prédéfinis, soit d’études longitudinales suivant les mêmes individus pendant un certain nombre d’années. Ces deux types comportent des biais. Les études transversales peuvent fautivement introduire des facteurs parasites (p. ex., une comparaison de sujets de 20 et de 80 ans peut négliger le fait que les derniers sont plus susceptibles d’avoir fumé qu’un jeune d’aujourd’hui). On considère généralement que les données des études longitudinales sont plus robustes, mais de telles données peuvent recéler des biais de sélection (p. ex., une scolarité ou un statut socioéconomique plus élevé). Obtenir de l’information sur les véritables conséquences physiologiques du vieillissement est un vrai défi.
La Dre Fruetel a débuté par une revue des effets du vieillissement sur le système cardiovasculaire. Des études d’autopsie suggèrent qu’un âge avancé est associé à une augmentation de la masse ventriculaire gauche (VG). Des études démontrent également une augmentation de la taille des myocytes et une diminution de leur nombre, ainsi qu’une prolifération focale de la matrice dans laquelle résident les myocytes. Il y a un accroissement de la réticulation du collagène. Pour ce qui est de la fonction systolique, il y a peu de changement au repos. Cependant, il y a une baisse de la stimulation bêta-adrénergique. L’effort fait apparaître des transformations : il y a réduction de l’augmentation de la fréquence et de la contractilité cardiaques due à l’effort, et le pic du débit cardiaque est atténué de 20 à 30 % en réponse à un effort maximal.
La fraction d’éjection (FE) maximale diminue pendant l’effort exhaustif en position debout. Fondamentalement, avec le vieillissement, le volume systolique est conservé dans une gamme de demandes physiques.
En revanche, la Dre Fruetel a fait remarquer que le volume diastolique changeait et qu’il y a une réduction du remplissage diastolique initial avec l’âge.
L’augmentation du remplissage diastolique final est due à une augmentation de la contraction auriculaire, et il y a une augmentation de la taille de l’oreillette. La Dre Fruetel a résumé ainsi les principaux changements physiologiques du cœur liés à l’âge : épaississement accru de la paroi du VG, altération du remplissage diastolique, et altération de la FE et de la fréquence cardiaque en réponse à l’effort. La Dre Fruetel a alors examiné la modification qualitative des artères avec le vieillissement (Figure 1). Des altérations structurelles se produisent et entraînent des irrégularités de la taille et de la forme des cellules endothéliales. Il y a fragmentation de l’élastine, et les artères deviennent plus longues, plus larges, plus épaisses et plus rigides. Les données de l’étude longitudinale de Baltimore sur le vieillissement (Baltimore Longitudinal Study of Aging – BLSA) ont démontré une augmentation de la taille de la racine de l’aorte. De plus, les chiffres issus de la BLSA montrent que l’épaisseur intima-média de la paroi de la carotide augmente de 2 à 3 fois.
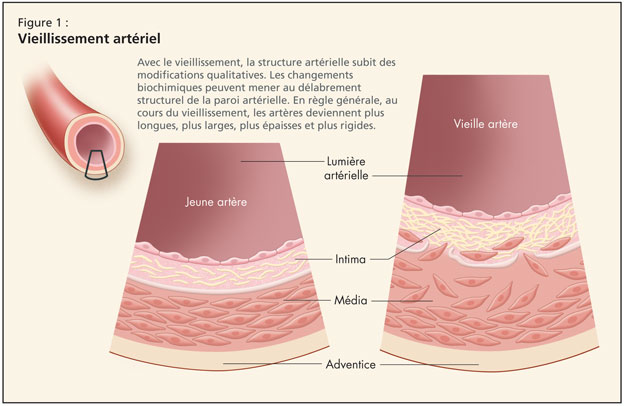
En ce qui concerne les changements biochimiques du système cardiovasculaire, il y a diminution de production et de libération de monoxyde d’azote. Lorsque le monoxyde d’azote pénètre dans une cellule, il décontracte les vaisseaux sanguins, réduit la croissance anormale du muscle vasculaire, prévient l’adhérence des plaquettes et des globules blancs aux parois de vaisseaux, et se lie aux radicaux libres. La Dre Fruetel a fait remarquer que certains chercheurs considèrent la baisse de disponibilité du monoxyde d’azote dans l’endothélium comme l’un des premiers signes du vieillissement artériel et comme un signe pathologique de l’athérosclérose. Parmi les autres principaux changements biochimiques, il y a aussi l’augmentation de l’angiotensine II avec l’âge, et une augmentation des marqueurs inflammatoires.
En passant de l’altération de la structure biochimique aux fonctions artérielles, elle a signalé que les effets conjugués de ces changements (p. ex., augmentation d’épaisseur de l’IM, disruption de l’élastine, accroissement du collagène, baisse du monoxyde d’azote, hausse de l’angiotensine II) induisaient un épaississement artériel. Les modifications qui en résultent se manifestent par une augmentation de la PA systolique et une diminution de la PA diastolique, un changement des ondes de pressions, et une augmentation de post-charge. La vitesse de l’onde de pression est altérée ainsi : plus l’élasticité artérielle est grande, plus la vitesse de l’onde de pression doit être faible. L’augmentation de la vitesse a des conséquences, car les vaisseaux ont à la fois une fonction de canalisation et d’amortissement. Un débit pulsatile plus important se traduit par un risque plus élevé de dommage des organes tels que le cerveau et les reins du fait de l’augmentation de post-charge. De tels changements physiologiques, conjugués aux effets du diabète, de l’hypertension, de la cigarette et de l’hyperlipidémie, conduisent à l’augmentation de la prévalence des maladies cardiovasculaires chez les personnes âgées.
La Dre Fruetel a ensuite exposé en détail certains des changements du système gastro-intestinal avec l’âge. Elle a abordé l’anorexie physiologique du vieillissement, un état au cours duquel la consommation et les besoins caloriques diminuent avec l’âge. Cet état a une étiologie multifactorielle : l’odorat des personnes âgées s’amenuise ; elles atteignent plus rapidement la satiété avec des taux plus faibles de leptines (surtout les hommes) ; leur prévalence de dysphagie augmente, en partie du fait d’une salivation réduite, mais plus généralement à cause des pathologies et des médicaments ; et elles ont plus de problèmes œsophagiens, et manifestent avec l’âge une altération de la vidange gastrique, en rapport avec la gastrine et le pepsinogène. Les individus âgés sont plus sujets aux atteintes gastriques en raison d’une susceptibilité plus importante à cause de plus faibles taux de prostaglandines gastriques et d’une épaisseur réduite de gel muqueux. Il n’y a pas de changement de la vidange gastrique en deçà d’un certain seuil calorique, ni de changement de la durée du transit du côlon. L’absorption gastro-intestinale change légèrement, avec une absorption réduite des vitamines et nutriments importants, comme les folates, les vitamines B12 et D, et le calcium.
En ce qui concerne le foie, sa taille est réduite d’un tiers à cause d’une baisse de la régénération cellulaire hépatique et d’un débit sanguin plus faible, et, malgré un plus faible nombre de mitochondries, l’activité reste inchangée. Fonctionnellement parlant, il n’y a pas de modification de la bilirubine ou des enzymes hépatiques, et les taux d’albumine sont normaux ou seulement légèrement plus faibles. Le traitement des médicaments par un foie vieillissant est légèrement altéré à cause du déclin du métabolisme hépatique, lié à une diminution de la masse et du débit sanguin hépatiques. Des études menées chez l’animal ont démontré une teneur hépatique plus faible de cytochrome P450 ; une étude faite chez l’homme a constaté un déclin progressif des taux de P450, pour atteindre une baisse de 30 % à 70 ans. Contrairement au foie, le pancréas ne présente aucun changement de taille, mais les volumes de sécrétion duodénale déclinent, tout comme la production d’insuline, aboutissant à des problèmes d’intolérance au glucose.
Finalement, la Dre Fruetel a décrit les modifications du système respiratoire humain liées à l’âge. Bien qu’elle reconnaisse la nécessité de plus amples recherches, il existe déjà certaines données fiables. Des études montrent qu’un changement se produit dans le revêtement épithélial, visible dans des populations de cellules issues de lavage alvéolaire, avec un pourcentage plus élevé de polynucléaires, mais plus faible de macrophages. Il y a une augmentation du rapport élastine sur collagène, se traduisant par une augmentation de la compliance pulmonaire ; de plus, il y a une diminution de la compliance de la paroi thoracique due à une calcification des articulations cartilagineuses autour des côtes, du sternum et de la colonne vertébrale. Le volume d’air augmente, mais il y a une perte de surface et un déclin global du nombre de capillaires par alvéole.
La spirométrie montre que le VEMS décroît de 0,3 litre par décennie ; les bais-ses de CVF sont un peu moindres. Le volume résiduel augmente, mais la capacité pulmonaire totale reste la même. D’une manière générale, les études montrent que le débit expiratoire de pointe change ; la plupart des changements liés à l’âge portent sur la phase d’expiration, et non pas sur l’inspiration.
Il existe des données en faveur d’une baisse de la force musculaire, la force diaphragmatique étant réduite de ~ 25 %. Du fait des modifications de la cage thoracique, les personnes âgées ont une force respiratoire réduite. Il y a une augmentation de la ventilation dite de l’espace mort. Des études de la capacité respiratoire de personnes âgées en bonne condition physique par rapport à des sédentaires ont mis en évidence une baisse du VO2 max, laquelle est présente chez tous, mais à un degré plus marqué chez ceux qui ont une moins bonne condition physique. Cependant, les chercheurs ont pu obtenir des améliorations (jusqu’à 15 %) du VO2 max en réponse à un entraînement physique.
Pour ce qui est des altérations des défenses pulmonaires, la Dre Fruetel a présenté la diminution de la clairance mucociliaire avec l’âge, de même que la baisse du réflexe de toux chez les personnes âgées lorsqu’elles sont exposées à des substances nocives, par rapport à une cohorte de personnes plus jeunes. Des études de personnes âgées ayant inhalé une substance nocive ont démontré que celles-ci nécessitent un stimulus plus fort pour tousser, et peuvent présenter une altération du système nerveux central quant à la perception d’une bronchoconstriction.