Télomères, télomérase et vieillissement
Conférencière : Chantal Autexier, Ph. D., Institut Lady Davis de recherches médicales, Hôpital général juif et Centre Bloomfield de recherche sur le vieillissement; départements de médecine et d’anatomie et de biologie cellulaire, Université McGill, Montréal (Québec).
La Dre Chantal Autexier a discuté du rôle des télomères dans le maintien de l’intégrité génétique et cellulaire, et du rôle de la perturbation des télomères dans la sénescence cellulaire et le vieillissement.
Télomères : description et rôle dans l’intégrité cellulaire
Les télomères sont des séquences répétitives d’ADN non codant (TTAGGG) qui protègent les extrémités des chromosomes eucaryotes linéaires. Chez les hommes, un complexe shelterin, formé de six protéines, se lie aux télomères1. La structure et la taille des télomères sont importantes pour le maintien de l’intégrité cellulaire (Figure 1). Les télomères empêcheraient les mécanismes de réponse aux lésions cellulaires de considérer les extrémités des chromosomes linéaires comme des cassures d’ADN double brin (notamment comme des lésions chromosomiques provoquées par des stress, tels que des radiations ionisantes). Une perturbation de la structure ou de la taille du télomère peut entraîner des fusions entre les extrémités des chromosomes, une instabilité et des anomalies chromosomiques, et des troubles de la division cellulaire (sénescence cellulaire; mort cellulaire; les cellules deviennent cancéreuses).
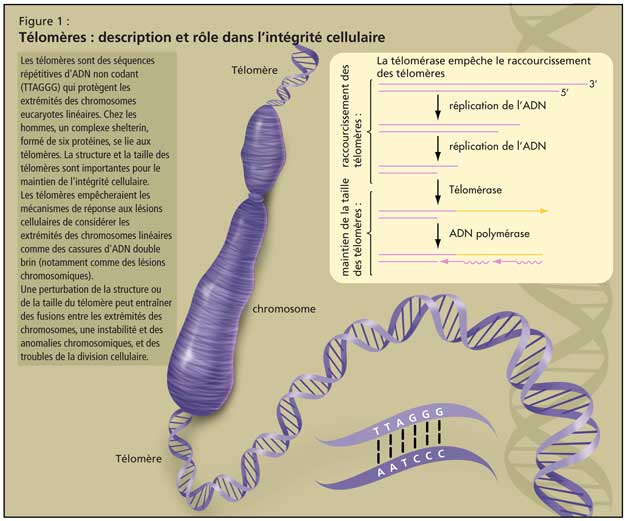
La majorité des cellules de l’orga-nisme sont incapables de conserver la taille du télomère d’une division à l’autre, car la machine de réplication de l’ADN est incapable de répliquer la totalité des extrémités chromosomiques. Par conséquent, le télomère se raccourcit avec chaque division cellulaire. Une fois une certaine limite atteinte (la limite de Hayflick), la majorité des cellules sortent du cycle cellulaire et rentrent en sénescence. Cependant, une petite proportion de cellules est capable de réintégrer le cycle cellulaire : ce phénomène est en général associé à une élongation des télomères et à une expression de la télomérase, une enzyme impliquée dans la formation et le maintien des télomères. Bodnar et ses collègues ont montré qu’une expression forcée de la télomérase inhibe la perte des télomères et l’arrêt de la croissance de fibroblastes humains normaux en culture, et suffit à l’élongation du télomère et à l’immortalisation cellulaire (prolongation de la durée de vie)2. À la différence de la majorité des cellules, certaines cellules, comme les cellules souches, les cellules de la lignée germinale et 85 % des cellules cancéreuses, expriment la télomérase. Par conséquent, ces cellules sont capables de maintenir la taille et la structure des télomères durant un grand nombre de cycles de division cellulaire.
Raccourcissement des télomères, sénescence cellulaire et vieillissement tissulaire
On appelle sénescence réplicative le processus par lequel une cellule sort du cycle cellulaire. Ce processus peut être déclenché par différents stress, comme des lésions dues aux radiations ou un stress oxydatif3,4. Dans de nombreux cas, une perte de l’intégrité des télomères est responsable de la sénescence ou y est associée.
Le cycle cellulaire est contrôlé par de multiples mécanismes de vérification qui détectent les lésions de l’ADN, activent les mécanismes de réparation et déclenchent la mort cellulaire lorsque les lésions ne peuvent être réparées. Les suppresseurs de tumeurs sont d’importants régulateurs du cycle cellulaire. Ils régulent la sénescence et la mort cellulaire, veillant à ce que toute cellule très abîmée meurt ou arrête de se diviser. Lorsque ces protéines de contrôle sont absentes ou ne fonctionnent pas correctement, les cellules porteuses de lésions continuent à se développer. Bien que les suppresseurs de tumeurs protègent un organisme, en empêchant l’accumulation de cellules abîmées, ils contribuent également au vieillissement tissulaire. En effet, à mesure que les cellules abîmées qui rentrent en sénescence sont éliminées, le pool des cellules responsables du renouvellement des tissus et du maintien de la fonction tissulaire diminue.
Chez l’homme et d’autres organismes, les tissus qui se renouvellent rapidement (paroi de l’intestin, peau, follicules pileux et moelle osseuse) sont les premiers affectés par le raccourcissement des télomères et la sénescence et la mort cellulaires. De nombreux troubles liés au vieillissement affectent ces tissus.
Selon la Dre Autexier, de nombreuses études ont montré une corrélation entre le raccourcissement des télomères et la sénescence réplicative, la mort cellulaire et le vieillissement, d’une part, et entre la préservation de la taille des télomères, la présence d’une activité télomérase et l’immortalisation cellulaire, la longévité ou la formation d’un cancer, d’autre part.
Perturbation des télomères et vieillissement
La Dre Autexier a expliqué que de nombreuses caractéristiques du vieillissement naturel chez l’homme sont liées à un déclin des mécanismes nécessitant un renouvellement cellulaire constant, ou à un défaut des mécanismes de protection empêchant l’apparition ou la survie de cellules présentant des anomalies génomiques. Il s’agit notamment d’une diminution des fonctions immunitaires et de la moelle osseuse, d’une modification de l’épaisseur de la peau, d’une moins bonne cicatrisation des blessures, de modifications structurales des tissus épithéliaux, d’une perte de la fécondité et d’une augmentation de l’incidence du cancer. Les recherches suggèrent maintenant qu’une perte de l’intégrité des télomères est l’un des mécanismes clés à l’origine des pathologies liées à l’âge et au vieillissement.
La Dre Autexier a expliqué qu’il existe des similarités phénotypiques entre des syndromes de vieillissement prématuré chez l’homme, comme l’ataxie- télangiectasie, le syndrome de Werner et la dyskératose congénitale (DC), et le vieillissement normal, notamment des cataractes, une ostéoporose, un grisonnement des cheveux et une neurodégénérescence5. Ces syndromes sont associés à une défectuosité des gènes jouant un rôle dans le maintien de l’intégrité génomique et télomérique. Les phénotypes associés à la DC s’observent d’abord dans les tissus soumis à un renouvellement cellulaire constant, comme l’intestin, l’épiderme et la moelle osseuse6,7. Les populations de patients atteints d’une forme dominante autosomique de la maladie ont des télomères plus courts, montrent des signes de la maladie plus tôt et une aggravation des symptômes à chaque génération successive. Les résultats sont en accord avec un mécanisme défectueux de maintien des télomères.
Effectivement, diverses formes de DC dérivent de mutations touchant des gènes directement impliqués dans le maintien de l’intégrité des télomères. À ce jour, les mutations identifiées comme étant associées à la DC affectent la télomérase, un élément du complexe télomérase appelé hTR (human Telo-merase RNA; ARN de la télomérase humaine) et un gène codant pour la dyskérine, une protéine qui se lie à l’hTR8,9.
Un modèle murin dans lequel le gène mTR a été inactivé a permis de confirmer la relation entre une activité défectueuse de la télomérase et le processus de vieillissement. Bien que ces souris fussent viables, les générations successives montraient un raccourcissement progressif des télomères et une diminution de la fertilité (la 6e génération étant infertile)10. Il est intéressant de noter que ces souris présentent également une mauvaise cicatrisation, une perte et un grisonnement des poils, une diminution du poids corporel, une atrophie des villosités intestinales, une insuffisance médullaire et une augmentation de l’incidence du cancer11,12.
La majorité des phénotypes observés dans ce modèle murin sont semblables à ceux des patients atteints de DC et, à un certain point, ressemblent aux pathologies liées à l’âge associées au vieillissement humain normal13.
Conclusion
La Dre Autexier a terminé sa présentation en observant que de nombreuses études au cours de ces quatre dernières années corrélaient la taille des télomères à la mortalité, la maladie d’Alzheimer et la longévité. Bien que ces études soient généralement des études de corrélation, il est intéressant de voir que la recherche s’intéresse à la longueur des télomères comme marqueur potentiel de certaines maladies associées au vieillissement14,15,16.
L’intégrité des télomères est un régulateur essentiel du vieillissement humain et de la formation de cancers. Cette observation suggère que des protéines impliquées dans le maintien des télomères pourraient représenter des cibles moléculaires d’interventions thérapeutiques dans le domaine du cancer et d’autres maladies liées au vieillissement.
Bibliographie
-
Blasco MA. Telomere length, stem cells and aging. Nat Chem Biol 2007;3:640-9.
-
Bodnar AG, Ouellette M, Frolleis M, et al., Extension of life-span by introduction of telomerase into normal human cells. Science 1998;279:349-52.
-
Campisi J. Senescent cells, tumor suppression, and organismal aging: good citizens, bad neighbors. Cell 2005;120:513-22.
-
Ithana K, Campisi J, Dimri GP. Mechanisms of cellular senescence in human and mouse cells. Biogerontol 2004;5:1-10.
-
Hasty P, Campisi J, Hoeijmakers J, et al. 2003. Aging and genome maintenance: lessons from the mouse? Science 2003;299:1355-9.
-
Kirwan M, Dokal I. Dyskeratosis congenita: a genetic disorder of many faces. Clin Genet 2008;73:103-12.
-
Marciniak R, Guarente L. Human genetics. Testing telomerase. Nature 2001;413:370-3.
-
Mitchell JR, Wood E, Collins K. A telomerase component is defective in the human disease dyskeratosis congenital. Nature 1999;402:551-5.
-
Dokal I, Vulliamy T. Dyskeratosis congenita: its link to telomerase and aplastic anaemia. Blood Rev 2003;17:217-25.
-
Blasco MA, Lee HW, Hande MP, et al. Telomere shortening and tumor formation by mouse cells lacking telomerase RNA. Cell 1997;91:25-34.
-
Rudolph KL, Chang S, Lee HW, et al. Longevity, stress response, and cancer in aging telomerase-deficient mice. Cell 1999;96:701-12.
-
Lee HW, Blasco MA, Gottlieb GJ, et al. Essential role of mouse telomerase in highly proliferative organs. Nature 1998;392:569-74.
-
Marciniak RA, Johnson FB, Guarente L. Dyskeratosis congenita, telomeres and human ageing. Trends Genet 2000;16:193-5.
-
Cawthon RM, Smith, KR, O’Brian E, et al. Association between telomere length in blood and mortality in people aged 60 years or older. Lancet 2003;361:393-5.
-
Panossian LA, Porter VR, Valenzuela HF, et al. Telomere shortening in T cells correlates with Alzheimer’s disease status. Neurobiol Aging 2003;24:77-84.
-
Nakamura K, Takubo K, Izumiyama-Shimomura N, et al. Telomeric DNA length in cerebral gray and white matter is associated with longevity in individuals aged 70 years or older. Experimental Gerontology 2007;42:944-50.

